.
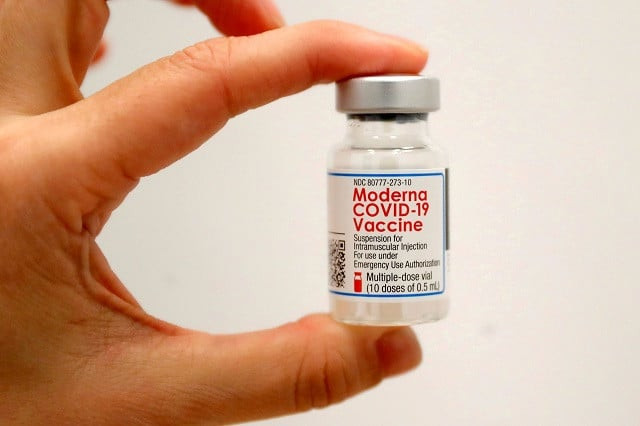
29 جنوری 2021 کو نیو یارک سٹی، نیو یارک، امریکہ میں مین ہٹن میں کورونا وائرس کی بیماری (COVID-19) وبائی بیماری کے دوران SOMOS کمیونٹی کیئر کے ذریعے چلائے جانے والے ایک پاپ اپ ویکسینیشن سائٹ پر ایک ہیلتھ کیئر ورکر نے Moderna COVID-19 ویکسین کی ایک شیشی رکھی ہے۔ تصویر: REUTERS
نیویارک:
ویکسین بنانے والی کمپنی موڈرنا نے بدھ کو کہا کہ یو ایس فوڈ اینڈ ڈرگ ایڈمنسٹریشن نے اپنی سابقہ پوزیشن واپس لے لی اور کمپنی کے نئے ایم آر این اے پر مبنی فلو شاٹ کا جائزہ لینے پر رضامندی ظاہر کی۔
پچھلے ہفتے امریکی فرم نے کہا کہ وفاقی ویکسین ریگولیٹر نے نئے شاٹ کے جائزے کی درخواست کو مسترد کرتے ہوئے اس کے کلینیکل ٹرائل کو ناکافی قرار دیا۔
لیکن موڈرنا نے کہا کہ ایک "تعمیری” میٹنگ کے بعد ایف ڈی اے نے بوڑھے بالغوں پر مرکوز ایک ریگولیٹری راستے کی بنیاد پر نظرثانی کے لیے درخواست کو قبول کر لیا ہے۔
موڈرنا نے ایک بیان میں کہا کہ کمپنی کی درخواست اب 50 سے 64 سال کے بالغوں کے لیے مکمل منظوری اور 65 سال اور اس سے زیادہ عمر کے بالغوں کے لیے تیزی سے منظوری چاہتی ہے۔ اس نے شاٹ مارکیٹ میں آنے کے بعد ایک اضافی مطالعہ کرنے پر بھی اتفاق کیا۔
ایف ڈی اے کا مسترد اس وقت ہوا تھا جب جسم نے بعض ویکسینز کے لیے منظوری کے طریقہ کار پر نظر ثانی کا مطالبہ کیا تھا، بشمول انفلوئنزا – صدر ڈونلڈ ٹرمپ کے تحت تجویز کردہ وفاقی پالیسی میں تبدیلیاں جس نے صحت عامہ اور طبی پیشہ ور افراد میں بڑے پیمانے پر خطرے کی گھنٹی کو جنم دیا ہے۔
نئے شاٹ میں ایم آر این اے ٹیکنالوجی کا استعمال کیا گیا ہے، جس پر صحت کے سربراہ رابرٹ ایف کینیڈی جونیئر، جو ایک مخر ویکسین کے شکوک ہیں، نے تنقید کی ہے۔ اس نے خاص طور پر وفاقی تحقیقی گرانٹس کو کاٹ دیا جو ایم آر این اے کی ترقی کو فنڈ دیتے تھے۔
یہ ٹرمپ کی پہلی صدارتی مدت کے دوران ان کی پوزیشن سے متصادم ہے، جب انہوں نے mRNA ٹیکنالوجی کو "جدید دور کا معجزہ” کہا۔
اس کا استعمال CoVID-19 وبائی مرض کے دوران تیزی سے حفاظتی ٹیکوں کو تیار کرنے کے لیے کیا گیا تھا جسے عالمی صحت کے حکام نے تیزی سے پھیلنے والی بیماری کے خلاف محفوظ اور موثر سمجھا۔ اسے لاکھوں جانیں بچانے کا سہرا ملا۔
موڈرنا کا نیا شاٹ پہلے ہی یورپی یونین، کینیڈا اور آسٹریلیا میں جائزے کے لیے قبول کر لیا گیا تھا۔
امریکی ویکسین کے اعلیٰ عہدیدار ونے پرساد نے موڈرنا کی منظوری کے لیے بولی کو مسترد کرتے ہوئے اس خط پر دستخط کیے تھے، جس میں کہا گیا تھا کہ کمپنی کا کلینیکل ٹرائل "مناسب اور اچھی طرح سے کنٹرول شدہ” نہیں تھا اور اس نے مارکیٹ میں موجود بہترین پروڈکٹ کے خلاف تجرباتی شاٹ کا تجربہ نہیں کیا تھا۔
بڑے ٹرائل میں Moderna نے اپنی نئی ویکسین کا موازنہ Fluarix سے کیا تھا، جو کمپنی GSK کی جانب سے منظور شدہ فلو شاٹ ہے۔
Moderna نے کہا کہ مسترد FDA کے ساتھ "پچھلے تحریری مواصلات سے مطابقت نہیں رکھتا”۔
بدھ کو ایک بیان میں Moderna کے CEO، Stephane Bancel نے کہا کہ "ہم FDA کی مصروفیت کی تعریف کرتے ہیں” ایک "تعمیری” میٹنگ میں جس کی کمپنی نے مسترد ہونے کے بعد درخواست کی تھی۔
"ایف ڈی اے کی منظوری کے بعد، ہم اس سال کے آخر میں اپنی فلو ویکسین دستیاب کرنے کے منتظر ہیں تاکہ امریکہ کے بزرگوں کو فلو سے خود کو بچانے کے لیے ایک نئے آپشن تک رسائی حاصل ہو۔”
جب سے ٹرمپ نے وائٹ ہاؤس پر دوبارہ قبضہ کیا، وہ اور صحت کے سربراہ کینیڈی دونوں ہی صحت عامہ اور طبی ماہرین کی جانب سے وسیع پیمانے پر محفوظ سمجھی جانے والی ویکسین کی حفاظت اور افادیت کے بارے میں شکوک پیدا کرنے اور بچوں کے حفاظتی ٹیکوں کے نظام الاوقات کو برقرار رکھنے پر شدید تنقید کا نشانہ بنے ہیں۔